Grâce à l’étude génomique des populations de chasseurs-cueilleurs Pygmées et d’agriculteurs Bantous d’Afrique centrale, des chercheurs de l’Institut Pasteur et du CNRS, en collaboration avec des équipes françaises et internationales1, ont montré pour la première fois que notre habitat et notre mode de vie peuvent influencer notre épigénome.
 Maisons de Pygmées
Maisons de Pygmées
Les scientifiques ont en particulier mis en évidence que chez ces populations africaines, un passage récent d’un habitat forestier à urbain pouvait affecter l’épigénétique des fonctions de la réponse immunitaire. Au contraire, le mode de vie historique de ces populations – sédentaire agriculteur ou chasseur-cueilleur nomade – pouvait toucher des fonctions plus pérennes, comme celles liées au développement, via une modulation par sélection naturelle de son contrôle génétique. Cette étude est publiée dans la revue Nature Communications le 30 novembre 2015.
Quelques rappels:
- Epigénétique?
Le terme a été créé en 1942 par Conrad Waddington, donc à une époque où on n’avait pas encore établi la nature ADN du support de l’information génétique contenue dans les chromosomes. Dans ce terme épigénétique, on trouve le teme épigénèse, qui est en rapport avec le développement des organismes.
En 1994, Holliday propose de définir l’épigénétique comme l’étude des changements d’expression des gènes transmissibles au travers des divisions cellulaires sans changement de la séquence de l’ADN.
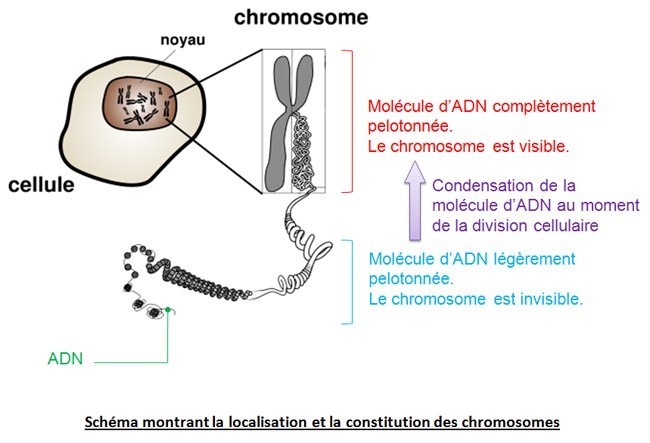
L’ensemble de notre patrimoine génétique est présent dans toutes nos cellules: voir le diaporama « A la recherche de notre programme génétique »
L’espèce humaine possède 46 chromosomes hérités de nos parents( voir la transmission de l’information génétique ici) sur lesquels on compte environ 25 000 gènes.
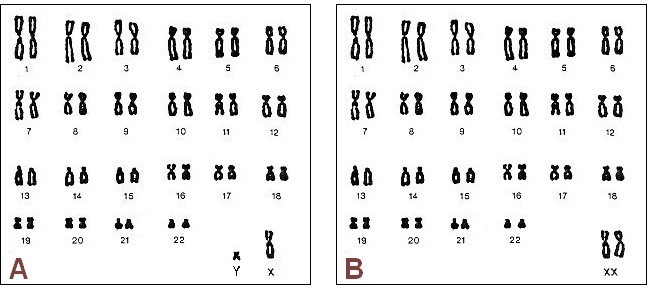
Caryotypes de l’espèce humaine (sexe masculin à gauche, féminin à droite) .On peut classer les chromosomes par paires selon la taille, la forme, la position du centromère et la place des bandes sombres :on obtient alors le caryotype de l’espèce.
- Toutes nos cellules contiennent la même information mais elles n’en font pas toutes le même usage :
une cellule de la peau est différente d’un neurone, une cellule du foie n’a pas les mêmes fonctions qu’une cellule du cœur…
De même, deux vrais jumeaux partagent le même génome mais ils ne sont jamais parfaitement identiques.
- Ces faits s’expliquent par l’épigénétique:
L’activité d’un gène peut être modulée (activation ou inactivation) par des facteurs émanant de l’organisme lui-même (facteurs internes) ou de l’environnement (facteurs externes)
L’épigénétique correspond donc à l’étude des changements dans l’activité des gènes, n’impliquant pas de modification de la séquence d’ADN et pouvant être transmis lors des divisions cellulaires. Contrairement aux mutations qui affectent la séquence d’ADN, les modifications épigénétiques sont réversibles.
- L’épigénétique et l’environnement
L’environnement interagit avec le génome pour déterminer le phénotype d’un organisme.
Un exemple chez l’abeille :on sait que la larve d’abeille qui reçoit de la gelée royale acquiert un phénotype de reine, alors que sans gelée royale elle devient une ouvrière stérile et bien différente de la reine.
Comment l’espèce humaine peut-elle s’adapter à son environnement, comme par exemple à son habitat (en forêt, en milieu rural ou urbain) ou à son mode de vie (chasseur-cueilleur nomade ou agriculteur sédentaire) ? (étude est publiée dans la revue Nature Communications le 30 novembre 2015)
Au cours de l’évolution humaine, l’environnement a en effet exercé une pression sélective au niveau génétique, entraînant la sélection de mutations de l’ADN avantageuses pour notre espèce. Des chercheurs de l’unité de Génétique évolutive humaine (Institut Pasteur/CNRS URA 3012), dirigée par Lluis Quintana-Murci, directeur de recherche CNRS à l’Institut Pasteur, viennent de prouver que l’habitat et le mode de vie des populations humaines peuvent aussi agir au niveau épigénétique, c’est-à-dire par des modifications modulant l’expression des gènes… plus de précisions ici:cp_quintana_20151126



