La partie « structure et transformation de la matière » du programme de TS version 2012-bac 2013 contient toute une partie sur les réactions chimiques par échange de protons, qui n’est rien d’autre que des réactions acido-basiques. Voyons un peu ce qu’il faut en retenir :
Je sais mesurer le pH d’une solution aqueuse.
Le pH est défini comme pH=-log([H3O+] ) ? [H3O+] = 10-pH
Ex : [H3O+] = 10-2 mol/L ? pH=2
Pour mesurer le pH, on peut utiliser du papier pH, un indicateur coloré ou un pH-mètre. Les indicateurs colorés donnent une couleur à la solution en fonction du pH de la solution :
Ainsi, ils sont pratiques et rapides à mettre en oeuvre, mais pas très précis. On obtient juste un intervalle de pH avec cette méthode. C’est pour cela qu’on a inventé le papier pH qui est un papier qui contient différents indicateurs colorés et permet avec la couleur du papier de déterminer son pH.
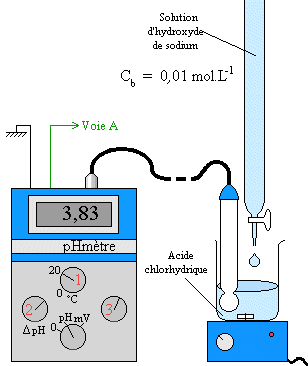
 Le problème, ici, c’est que la détermination se fait au pH près. Rapide, mais pas précis. On a donc une méthode beaucoup plus précise : le pH-mètre :
Le problème, ici, c’est que la détermination se fait au pH près. Rapide, mais pas précis. On a donc une méthode beaucoup plus précise : le pH-mètre :
Mais il est cher et un peu délicat à mettre en œuvre (étalonnage, rinçage, fragilité). Chaque méthode a donc ses avantages et ses inconvénients.
Je sais reconnaître un acide, une base dans la théorie de Brönsted
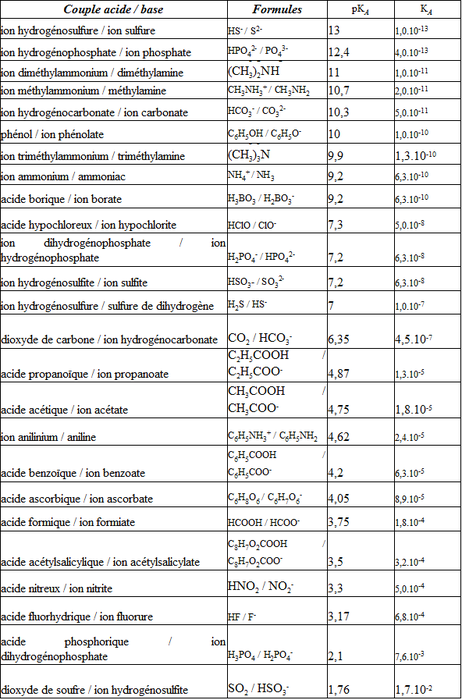
Un acide est une espèce chimique susceptible de céder un ou plusieurs ion H+ ( du type AH, par exemple) tandis qu’une base est une espèce chimique susceptible de capter un ou plusieurs ion H+ (du type A–). On obtient donc un couple AH/A– qui ne diffère que d’un H+ : AH = A– + H+
Je sais utiliser les symbolismes ?, ? et ? dans l’écriture des réactions chimiques pour rendre compte des situations observées.
Lorsqu’on dissout un acide fort dans l’eau, la réaction entre l’acide et l’eau totale, c’est à dire qu’elle cesse seulement à la disparition d’un réactif, en l’occurrence l’acide. Dans ces conditions, on écrit :
AH+H2O ? A– + H3O+
Lorsqu’il s’agit d’un acide faible, la réaction s’arrête avant que l’acide ait complètement disparu car la réaction inverse est possible A– + H3O+ ? AH+H2O, ainsi, on écrit :
AH+H2O ? A– + H3O+
Pour la dissolution d’une base dans l’eau, c’est le même principe :
Base Forte : B+H2O ? BH+ + HO–
Base Faible : B+H2O ? BH+ + HO–
Identifier l’espèce prédominante d’un couple acide-base connaissant le pH du milieu et le pKa du couple.
De la relation Ka= [A–][H3O+]/[AH], il découle pH=pKa+log([A–]/[AH]). Ainsi, s’il y a plus de A– que de AH dans la solution, le pH est supérieur à pKa, si c’est AH qui prédomine, alors le pH est inférieur à pKa. L’inverse est également vrai : si le pH est supérieur à pKa, alors il y a plus de A– que de AH et si le pH est inférieur à pKa, alors c’est AH qui prédomine. Cela se résume par le diagramme de prédominance qui doit être connu :
Les indicateurs colorés sont un cas particulier d’espèces chimiques telles que la forme acide et la forme basique n’ont pas la même couleur en solution.
Je sais déterminer une constante d’acidité.
La constante d’acidité est Ka= [A–][H3O+]/[AH] dont on déduit le pKa par pka=-log(Ka). Il se trouve que du moment qu’un acide faible et sa base sont en solution, ils vérifient cette relation.
Ce point est assez délicat. Il s’agit d’une compétence expérimentale qui met en œuvre un certain nombre de calculs. Une des méthodes consiste à mesurer le pH d’un solution dont la concentration en acide est c.
Lorsqu’on dissout un acide faible dans l’eau, nous avons vu que la réaction s’arrêtait avant que l’acide ait totalement disparu. Ce qui se traduit par le tableau d’avancement suivant :
| x | AH + | H2O ? | A- + | H3O+ | |
| Ei | x=0 | cV | solvant | 0 | 0 |
| Eint | x | cV-x | solvant | x | x |
| Ef | xf | cV-xf | solvant | xf | xf |
| Emax | xmax = cV | 0 | solvant | cV | cV |
Faut-il savoir faire un tel tableau d’avancement pour le bac 2013 ? Il est difficile de répondre. Je pensais que non mais certaines personnes pensent qu’ils ne sont pas mentionnés dans le programme parce que c’est un outil usuel. L’avenir nous le dira. Une fois qu’une année ou deux de sujets seront tombés, nous saurons s’ils sont demandés. Pour l’instant, je conseille à mes élèves de savoir les faire.
Ici, on voit grâce au tableau que [A–]=[H3O+]=xf/V. D’autre part, on peut écrire que [AH]+[A–]=(cV-xf+xf )/V=c. Il est donc possible de calculer [H3O+] à partir du pH, donc d’en déduire [A–] puis [AH]. Ce qui permet de calculer Ka.
Notons qu’il n’est pas nécessaire d’écrire le tableau d’avancement pour obtenir [A–]=[H3O+] et [AH]+[A–]=c mais c’est parfois plus simple à comprendre avec.
Je sais calculer le pH d’une solution aqueuse d’acide fort ou de base forte de concentration usuelle.
Dans le cas d’un acide fort, la concentration des ions oxonium H3O+ (un terme à connaître, on ne sait jamais) est égale à la concentration de la solution puisque la réaction AH+H2O ? A– + H3O+ est totale. Ainsi,
pH=-log(c) pour un acide fort
Pour une base forte, c’est la réaction B+H2O ? BH+ + HO– qui est totale. Ainsi, c’est [HO–] qui est égal à c. Pour avoir la relation entre [HO–] et le pH, il faut utiliser l’expression du produit ionique de l’eau : Ke=[H3O+].[HO–] où Ke=10-14 à 20°C.
Ainsi, si [HO–]=c, on obtient 10-pKe=10-pH.c ? 10-pKe=10-pH.10-log(c)=10-pH-log(c) soit :
pH=pKe+log(c) pour une base forte
Faut-il connaître toute la démonstration ? Non je ne pense pas mais la comprendre devrait permettre de résoudre certains problèmes de sujet de bac.
Je sais mettre en évidence l’influence des quantités de matière mises en jeu sur l’élévation de température observée lors d’une réaction entre un acide fort et une base forte.
Il s’agit ici d’une compétence expérimentale dont le principe est de mesurer l’élévation de température lors de l’ajout d’un acide fort à une base forte. En augmentant les quantités de matières mises en jeu, on observe une plus grande élévation de température.
Je sais extraire et exploiter des informations pour montrer l’importance du contrôle du pH dans un milieu biologique.
Pour s’entraîner à cette compétence, on pourra faire le sujet zéro N°2 proposé sur le site eduscol, site officiel du ministère. Une fois l’exercice fait, on pourra regarder la correction proposée par le ministère.


5 thoughts on “Réactions chimiques par échange de protons : que faut-il en retenir ?”