Identification des ions dans l’eau : Mesure du pH

UNE SOLUTION AQUEUSE : QU’EST CE QUE C’EST?
Une solution aqueuse est une solution liquide composé d’eau contenant un mélange de nombreuses espèces chimiques : atomes, molécules, ions.
Le cola, l’eau salée, la pluie, les solutions acides, les solutions basiques et les solutions salines sont des exemples de solutions aqueuses.
Dans ce cours de chimie, nous allons voir comment identifier certains ions qui sont présent dans les solutions aqueuses.

Laboratory glassware on blue background
ACIDITÉ ET BASICITÉ D’UNE SOLUTION AQUEUSE
Une solution aqueuse contient donc en majorité des molécules d’eau H2O. Elle contient également les ions hydrogène H+ et les ions hydroxyde HO − en plus ou moins grande quantité. C’est la quantité de ces ions qui détermine notamment une sensation macroscopique d’acidité ou encore un caractère de basicite.
| A RETENIR Les ions H+ qui sont responsables de l’acidité. Les ions OH– qui sont responsables de la basicité. |
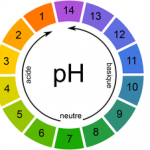
TROIS TYPES DE SOLUTIONS AQUEUSES : INTRODUCTION AU PH
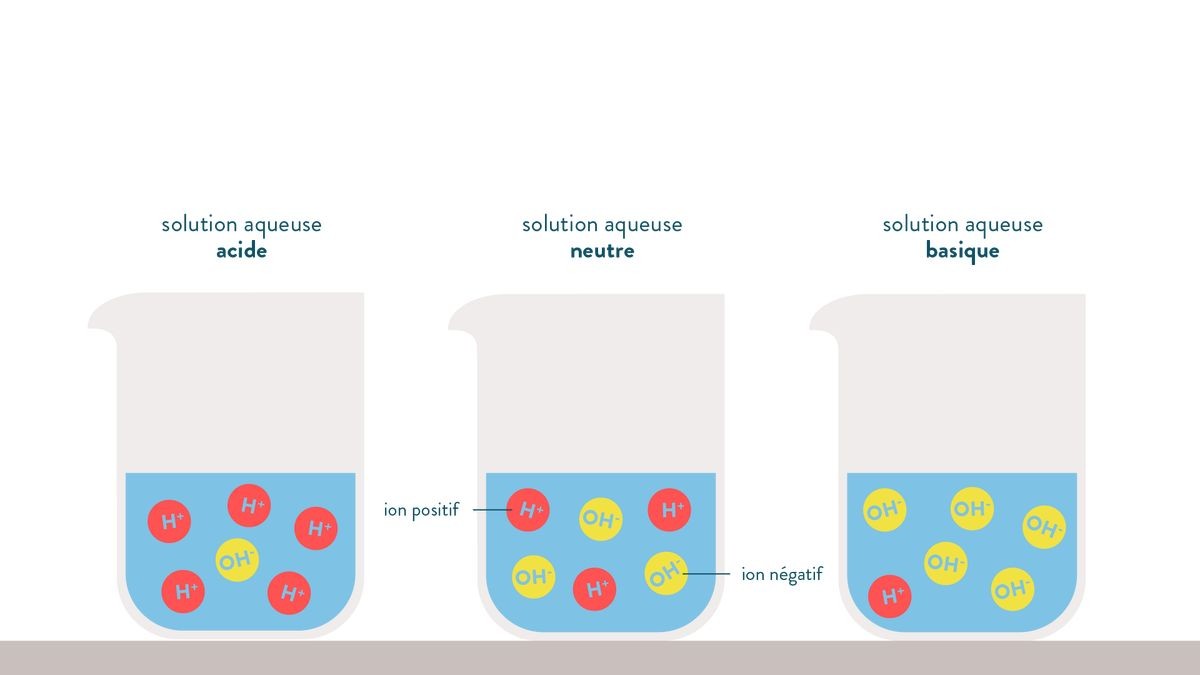
On définit trois types de solutions aqueuses en fonction de la concentration en ions H+ et OH- présents dans la solution aqueuse :
– Lorsqu’il y a autant d’ions H+ que d’ions OH-dans la solution acqueuse : la solution est dite neutre
– Lorsqu’il y a plus d’ions H+ que d’ions OH- dans la solution acqueuse : la solution est dite acide
– Lorsqu’il y a plus d’ions OH- que d’ions H+ dans la solution : la solution est basique.
| A RETENIR Il distingue trois types de solutions aqueuses différentes : les solutions acides, les solutions neutres et enfin les solutions basiques. La chimie propose des méthodes pour mesurer si une solution est acide, neutre ou basique et à quel degré. |
MESURE DE L’ACIDITÉ PAR LE PH
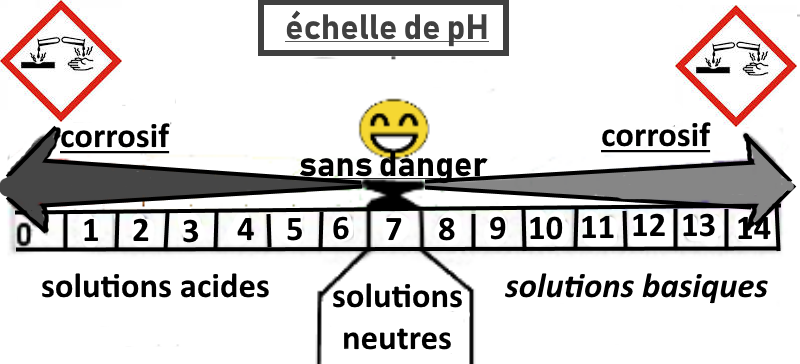
Les propriétés acides d’une solution aqueuse peuvent être mises en évidence par la mesure d’une grandeur physique appelée pH, ou « potentiel Hydrogène ». On parle aussi d’echelle de pH. L’echelle de pH est divisé en 14 degrés. 0 étant le degré le plus acide et 14 étant le degré le plus alcalin. 7 est le degré neutre, l’eau pure s’y situe.
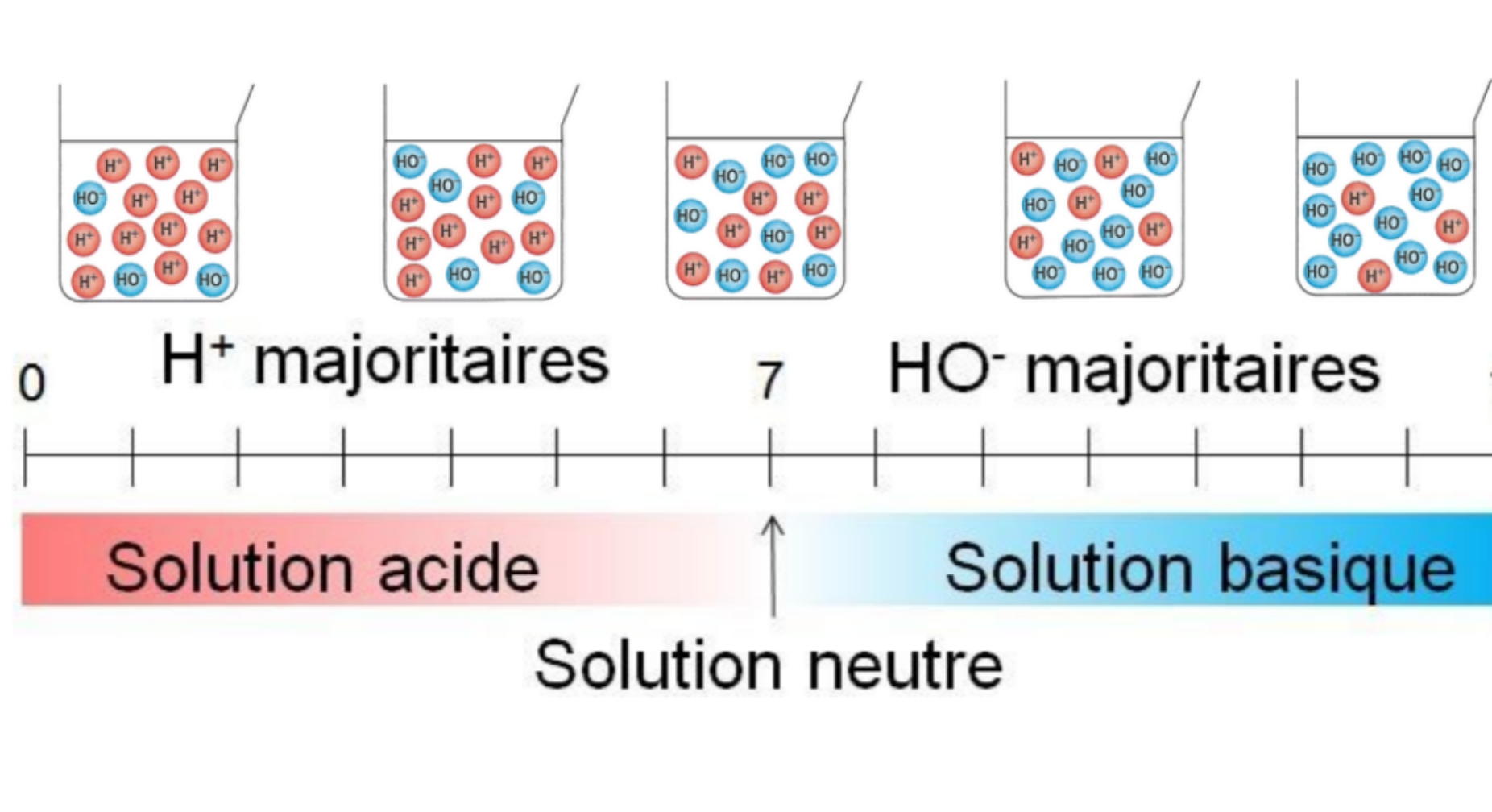
| A RETENIR Cas 1 : Lorsque la présence des ions H+ est majoritaire, la solution aqueuse est dite acide si son pH est inférieur à 7. Cas 2 : Dans le cas où il y a autant d’ions H+ que d’ions OH-, la solution aqueuse est dite neutre si son pH est égal à 7. Cas 3: Lorque la présence des ions OH- est majoritaire, la solution aqueuse est dite basique si son pH est supérieur à 7. |
PH DE QUELQUES PRODUITS COURANTS
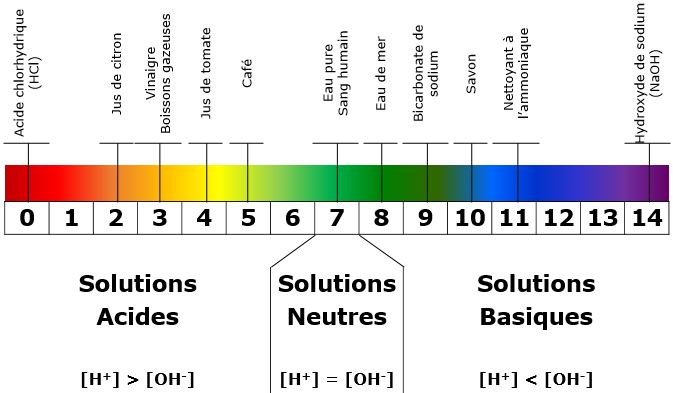
On observe que le pH du jus de citron pH(citron) = 2. Le pH du vinaigre pH(vinaigre) = 3.
On peut en conclure que le pH du citron est plus acide que celui du vinaigre.
De même, on observe que le pH de l’eau de javel pH(javel) = 12. Le pH de L’eau savonneuse pH(eau savonneuse) = 10. On en déduit que le pH de la javel est plus basique que celui de l’eau savonneuse.
| A RETENIR Une solution est d’autant plus acide que son pH est faible et tend vers la valeur pH = 0. De même, une solution est d’aurant plus basique qie son pH est grand et tend vers la valeur pH = 14. |
| EXERCICE Range les éléments suivants du plus acide au plus basique : pH(lait) = 6,72 pH(javel) = 11,5 pH(eau pure) = 7 pH(produit vaisselle) =7,5 pH(lessive) = 10 pH(jus d’orange) = 4 pH(jus de citron) = 1,8 pH(déboucheur) = 13 |
MESURE DU PH
La mesure du pH d’une solution peut se faire au moins par deux méthodes de précision différente. On évalue le pH d’une solution aqueuse grâce au nuancier d’un papier indicateur de pH (il suffit de déposer une ou deux gouttes de la solution à tester sur un morceau de bandelette). On peut aussi le mesurer grâce à un appareil appelé le pH-mètre.

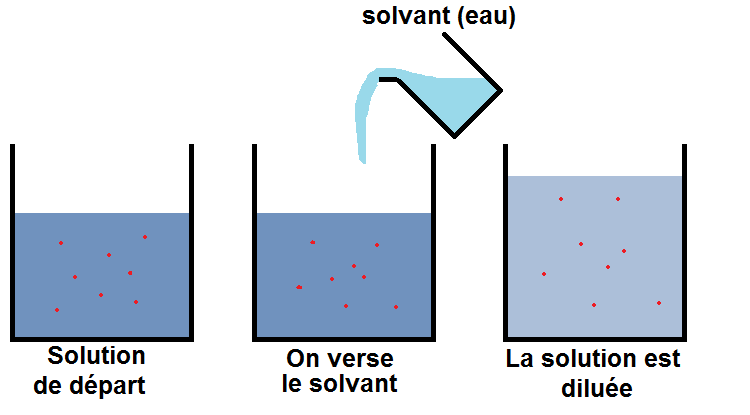
EFFET DE LA DILUTION SUR LE PH
Une dilution consiste tout simplement à ajouter de l’eau dans une solution aqueuse.
Elle fait donc augmenter la proportion de solvant par rapport à celle des solutés
Cas où l’on dilue une solution acide :
Lorsqu’on dilue une solution acide, elle devient un peu moins acide et son pH augmente pour se rapprocher de 7.
Cas où l’on dilue une solution basique :
A l’inverse, lorsqu’on dilue une solution basique, son pH diminue pour se rapprocher également de 7.
RÈGLES DE SECURITE CHIMIQUE
Les solutions acides et basiques sont corrosives, elles peuvent entraîner des brûlures graves de la peau, des muqueuses et des yeux. Particulièrement les solutions concentrées. Il y a donc des règles de sécurité à respecter associées à la manipulation et à l’utilisation des solutions acides et basiques concentrées.
EXERCICES POUR S’ENTRAÎNER
CHIMIE IDENTIFICATION DES IONS Notions de pH, acidité, basicité, pictogramme de sécurité.


Laisser un commentaire