Le chapitre « Contrôle qualité par dosage » du programme de TS 2012 – bac 2013 arrive assez tard dans le programme bien qu’il puisse être utilisé dans de nombreux chapitres le précédant (cinétique, transformation en chimie organique), j’ai donc décidé de le traiter dès la fin de ce premier trimestre. Il n’y a pas beaucoup de compétences exigibles en apparence (4 seulement) mais il faut se méfier de l’arbre qui cache la forêt… Voyons cela en détail :
Je sais déterminer la concentration d’une espèce à l’aide de courbes d’étalonnage en utilisant la spectrophotométrie et la conductimétrie, dans le domaine de la santé, de l’environnement ou du contrôle de la qualité.
Le principe de la détermination d’une concentration par étalonnage est assez simple. Il consiste à étudier une grandeur physique qui dépend de la concentration. Lorsque l’espèce chimique étudiée donne une couleur à la solution, on utilisera tout naturellement l’absorbance tandis que lorsque l’espèce chimique est ionique, on mènera une étude conductimétrique. Dans les deux cas, la grandeur physique (A pour l’étude colorimétrique, ?, la conductivité en conductimétrie) est proportionnelle à la concentration. Pour l’absorbance, il s’agit de la loi de Beer-Lambert :
A = k.c
Pour la conductimétrie, c’est la loi de Kohlraush :
?=??i.[Xi]
Bon, ici les choses peuvent vite devenir très compliquée (rien que le nom des lois…), il y a ?i dans l’expression, il va falloir expliquer ce que c’est et je vais vous embrouiller pour rien. Donc on retiendra que A et ? sont proportionnels à la concentration de la solution et qu’on a des appareils pour mesurer A et ? directement. Ainsi, en prenant un jeu de solution de concentrations différentes, on peut tracer A ou ? en fonction de c.
Monsieur, Quand on trace A en fonction de c, A il est en abscisse ou en ordonnée ?
Il est en ordonnée comme dans y en fonction de x.
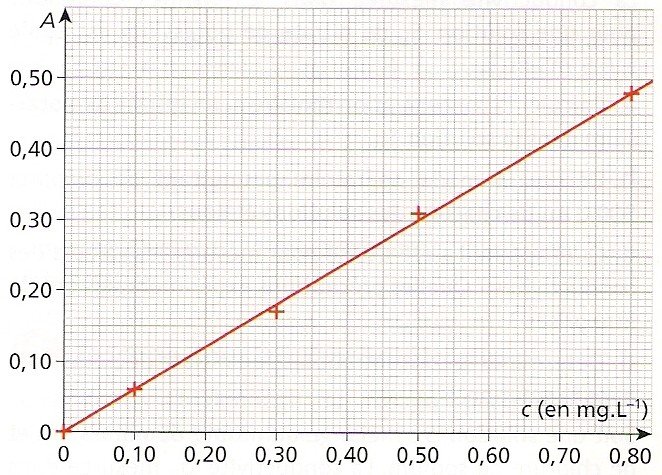
On obtient donc des trucs du genre :
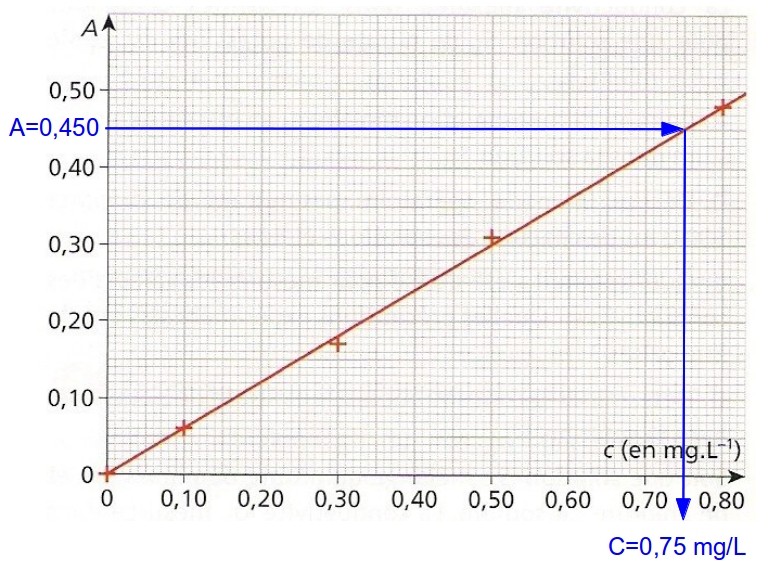
Ensuite, on mesure A ou ? pour la solution dont on veut déterminer la concentration. Par exemple, A=0,450. Et là, on a deux solutions : soit on détermine le coefficient directeur de la droite et on calcule la concentration correspondante, soit on fait une résolution graphique.
La première méthode nous donnera quelque chose du genre : coeff directeur=0,30/0,50=0,60 donc A=k.c où k=0,60. Ainsi, pour A=0,450, on trouve c=A/k=0,450/0,60=0,075 mg/L. Vous avez fait attention aux chiffres significatifs ?
0,075 mg/L qu’on peut également trouver graphiquement en reportant A=0,450 sur la droite et en lisant la concentration correspondante :
Je sais établir l’équation de la réaction support de titrage à partir d’un protocole expérimental.
Déjà, il faut comprendre la différence entre dosage et titrage. Un dosage est une méthode consistant à déterminer une concentration d’une espèce chimique. Un titrage est un dosage mettant en oeuvre une transformation chimique. Le titrage est donc toujours destructif puisque l’espèce titrée est détruite dans la réaction de titrage.
Généralement la réaction à écrire est soit une réaction d’oxydo-réduction, soit une réaction acido-basique. Je vous laisse regarder les pages correspondante où cela a déjà été traité.
Je sais déterminer la concentration d’une espèce chimique par titrage par le suivi d’une grandeur physique et par la visualisation d’un changement de couleur, dans le domaine de la santé, de l’environnement ou du contrôle de la qualité.
Dans un titrage, on détermine la concentration inconnue en ajoutant une espèce chimique qui va consommer toute l’espèce dont on veut déterminer la concentration. Le truc c’est d’arriver à déterminer l’équivalence qui est le moment où le réactif titrant (celui dont on connaît la concentration) a été introduit en quantité suffisante pour éliminer tout le réactif à titré et pas plus. Dit autrement -comme un chimiste- l’équivalence c’est le moment où les réactifs ont été introduit dans les proportions stœchiométriques. Dans ces conditions, on peut écrire une relation entre les quantités de réactifs titrant et titré :
n(réactif titrant)/coeff stoechio(titrant) = n(réactif titré)/coeff stoechio(titré)
Le problème c’est que lorsqu’une espèce chimique disparaît elle le fait de manière plutôt discrète. Il faut donc trouver un truc pour arriver à déterminer le moment où une espèce chimique disparaît.
Si les espèces chimiques titrée ou titrante ont le bon goût de donner une couleur à la solution, tout va bien. Il suffit de surveiller le changement de couleur de la solution. Dans ce cas, on parle de titrage colorimétrique. Voici ce que cela donne (merci à Isabelle Taride et Jean-Claude Desarnaud, professeurs dans l’académie d’Aix-Marseille) en animation : titrage_redox.
Dans le cas où les solutions ne sont pas colorées, il faut trouver une autre ruse pour déterminer l’équivalence. Si on souhaite titrer un acide par une base ou une base par un acide, on peut faire un titrage ph-métrique. Voilà ce que ça donne (et encore merci à Isabelle et Jean-Claude pour leur excellent travail) en animation : titrage_ph
Vous avez cliqué sur la pipette pour voir comment on s’en sert ? Voici l’animation : pipette_titrage. Et pour la burette ? Encore une belle animation : burette_titrage.
Je sais interpréter qualitativement un changement de pente dans un titrage conductimétrique.
Et lorsqu’on ne cherche pas à déterminer la concentration d’un acide ou une base, ni d’une espèce chimique colorée en solution, comment faire ? Si c’est un ion, il reste une solution : le titrage conductimétrique. Cette fois-ci, on titre un ion à l’aide d’un autre ion qui le fait précipiter.
Prenons un exemple : si l’on veut déterminer la concentration des ions chlorures, on peut utiliser des ions argents. En effet, ceux-ci réagissent et forment un précipité selon la réaction :
Ag+(aq) + Cl–(aq) ? AgCl(s) (1)
Prenons une solution de chlorure de potassium (K++Cl–), que l’on titre à l’aide d’une solution de nitrate d’argent (Ag++NO3–). Avant d’avoir versé la moindre goutte de nitrate d’argent, la conductivité s’exprime : ?=?K+.[K+]+?Cl-.[Cl–].
Après avoir versé de la solution de nitrate d’argent, les ions chlorures ont disparu dans la réaction (1) tandis qu’il est apparu des ions nitrates NO3– dans la solution. Pour un ion chlorure disparu, il y a eu un ion argent versé avec son ion nitrate. Les ions chlorures manquant sont donc remplacés par des ions nitrates. Comme ceux-ci ont une conductivité moindre, la conductivité de la solution diminue.
Ce processus va continuer jusqu’à l’équivalence. Moment où tous les ions Chlorures auront été remplacés par des ions nitrates et où la conductivité s’écrira : ?=?K+.[K+]+?NO3-.[NO3–].
Après l’équivalence, les ions argents seront en excès et ne vont donc plus être consommés par les ions chlorures. Ils vont donc (enfin) participer à la conductivité de la solution : ?=?K+.[K+]+?NO3-.[NO3–]+?Ag+.[Ag+] qui va se mettre à augmenter.
L’ensemble nous donne quelque chose comme cela :
pour lequel on détermine l’équivalence au minimum de la conductivité.
Ouf ! Nous sommes venu à bout des méthodes de titrage à connaître pour le bac S 2013.