I – DISSOLUTION DE SOLIDES DANS L’EAU
Expérience :
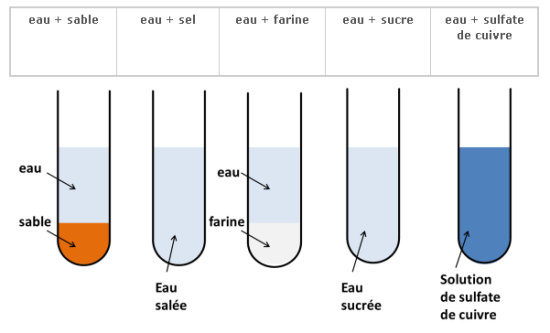
On verse de l’eau dans plusieurs tubes à essai puis on y ajoute plusieurs solides. On agite et on laisse reposer.
Après agitation, on observe que certains solides disparaissent (sel, sucre, sulfate de cuivre,…) et d’autres pas (farine,sable,..).
Interprétation :
Les solides qui peuvent se dissoudre dans l’eau sont dits : solubles dans l’eau.
Les autres sont dits insolubles dans l’eau.
Le mélange homogène obtenu par dissolution dans l’eau est une solution aqueuse.
Le sel, sucre,… sont les solutés et l’eau est le solvant.
Lorsqu’on veut dissoudre une quantité trop importante de sel dans l’eau, celui-ci ne se dissout plus : on dit que la solution est saturée en sel.
CONCLUSION :
II – LIQUIDES MISCIBLES ET NON MISCIBLES À L’EAU.
Expérience 1:
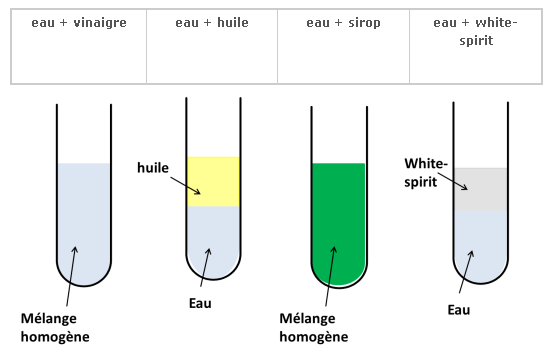
On verse de l’eau dans plusieurs tubes à essai puis on y ajoute plusieurs liquides. On agite puis on laisse reposer.
Le vinaigre et le sirop forment avec l’eau un mélange homogène : on dit qu’il sont miscibles à l’eau.
L’huile et le white-spirit ne forment pas un mélange homogène avec l’eau : ils sont non miscibles à l’eau.
Expérience 2 :
On souhaite séparer le mélange eau + huile. Pour cela il suffit de verser le mélange eau+ huile dans une ampoule à décanter et laisser reposer le mélange. On observe une décantation.
Après avoir enlevé le bouchon de l’ampoule à décanter, on ouvre le robinet et on laisse couler l’eau dans le bécher jusqu’à ce que la surface de séparation « eau-huile » arrive au niveau du robinet.
Dans le bécher, on a récupéré l’eau, puis il ne reste plus qu’à verser l’huile dans un autre bécher.
La séparation est effectuée.
CONCLUSION :
De nombreux liquides sont miscibles à l’eau.
Les liquides non miscibles peuvent être séparés avec une ampoule à décanter.
III – CONSERVATION DE LA MASSE.
Expérience :
On place sur le plateau d’une balance un morceau de sucre et un bécher contenant de l’eau. On relève la masse. Puis on met le sucre dans l’eau et on mélange. On note à nouveau la masse.
On réalise la même expérience avec un bécher d’eau et de sirop.
Observation :
La masse ne change pas lors de la dissolution du sucre ou lors du mélange sirop-eau.
CONCLUSION :
La masse d’un mélange est égale à la masse des substances mélangées.




Leave a reply
Vous devez vous connecter pour publier un commentaire.