Voici les compétences exigibles du programme de TS bac 2013 sur l’aspect macroscopique des transformations en chimie organique :
Je sais reconnaître les groupes caractéristiques dans les alcool, aldéhyde, cétone, acide carboxylique, ester, amine, amide.
Je sais utiliser le nom systématique d’une espèce chimique organique pour en déterminer les groupes caractéristiques et la chaîne carbonée.
Cette compétence a déjà été traitée dans l’article sur la nomenclature.
Je sais distinguer une modification de chaîne d’une modification de groupe caractéristique.
Une molécule organique est constituée d’une chaîne carbonée et d’un ou plusieurs groupes caractéristiques. On retrouve cette structure dans le nom de la molécule. La chaîne donne le nom tandis que le groupe caractéristique donne le suffixe (et le préfixe dans le cas où il y a plusieurs fonctions). Ainsi le 2-éthyl-pentanoïque porte le groupement caractéristique acide carboxylique (2-éthyl-pentanoïque) sur une chaîne portant 5 atomes de carbones (2-éthyl-pentanoïque) ramifiée (2-éthyl-pentanoïque). Une transformation de chimie organique peut modifier la chaîne carbonée ou un groupe caractéristique.
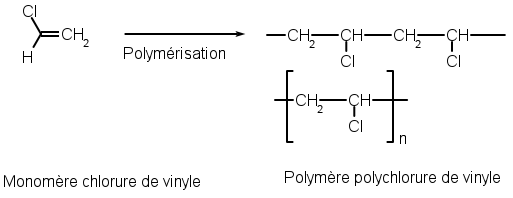
Un exemple de modification de chaîne : la polymérisation, qui a été introduite en 2de, comme la synthèse du polychlorure de Vinyle (PVC) où la double liaison est cassée pour associer les molécules entre elles :
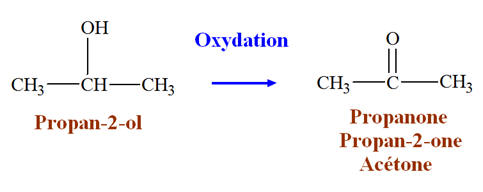
Un exemple de modification de groupe caractéristique : l’oxydation du butan-2-ol.
Je sais déterminer la catégorie d’une réaction (substitution, addition, élimination) à partir de l’examen de la nature des réactifs et des produits.
Substitution : un groupement d’atome est remplacé par un autre. Généralement, il y a alors 2 réactifs et 2 produits : A-X + Y-B -> A-Y + X-B
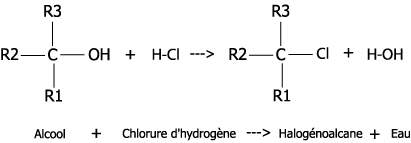
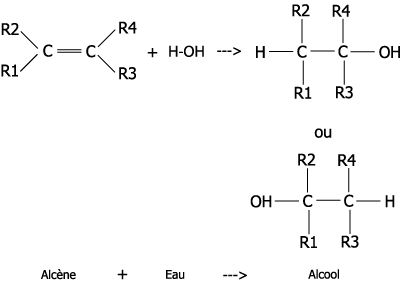
Addition : cette fois-ci, on ajoute un groupe généralement à la place d’une double liaison. Il y a souvent 2 réactifs et un produit :
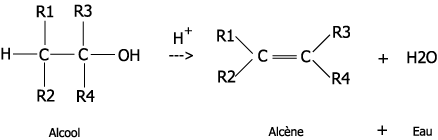
Élimination : dans ce cas, on supprime un groupe d’atomes et on obtient une double liaison. Il y a souvent 1 réactifs et 2 produits. Comment est-ce possible allez-vous dire ? En soumettant la molécule aux bonnes conditions expérimentales : catalyseur, température.
Je sais déterminer la polarisation des liaisons en lien avec l’électronégativité (table fournie).
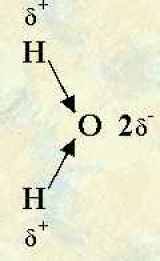
L’électronégativité mesure la capacité d’un atome à tirer les électrons vers lui dans le cadre d’une liaison covalente. Pour déterminer la polarité d’une liaison, il faut comparer l’électronégativité des atomes mis en jeu. Le plus électronégatif attirera plus les électrons et sera légèrement chargé négativement tandis que l’autre aura un léger déficit d’électrons et sera chargé légèrement positivement. On représente ces petites charges à l’aide d’un +? (delta) sur l’atome chargé positivement et -? sur l’atome chargé négativement.
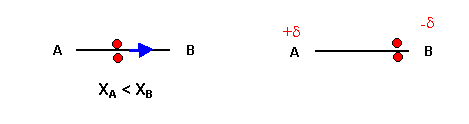
La valeur de l’électronégativité n’est pas à connaître et elle sera fournie dans un sujet de bac. Mais nous pouvons avoir le schéma suivant en tête par rapport à la classification périodique des éléments :

Dans une table des électronégativité, on trouve que l’hydrogène a une électronégativité de 2,2 tandis que pour le chlore elle vaut 3,16 et pour l’oxygène, 3,44. Dans la molécule de chlorure d’hydrogène ou la molécule d’eau, la liaison est donc polarisée :
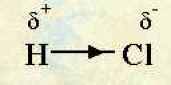 |
 |
Je sais identifier un site donneur, un site accepteur de doublet d’électrons.
Site donneur : un atome comportant un doublet non liant (ex : O ou Cl) ou une charge électrique négative (ex O dans HO-) est susceptible de fournir un doublet d’électrons pour former une nouvelle liaison. Une liaison double est aussi riche en électrons (ex : C=C) et est également un site donneur de doublets d’électrons. Dans les 2 exemples montrés ci-dessus, le Chlore et l’Oxygène sont des sites donneurs.
Site accepteur : un atome chargé positivement (ex : H+) ou en déficit d’électron dans une liaison polarisée (ex : C dans C=O ou dans C-Cl) est susceptible de capter un doublet d’électron pour engager une nouvelle liaison.
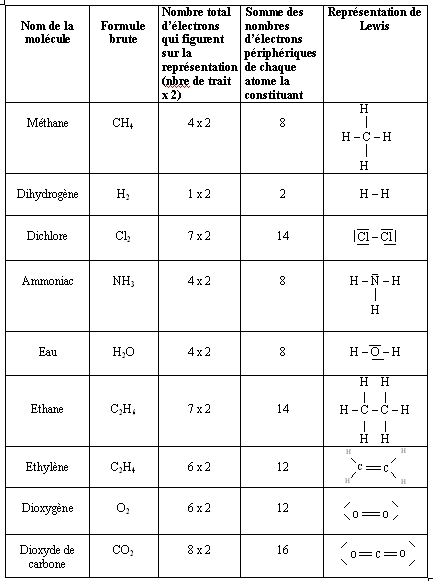
Pour repérer les sites donneurs et accepteurs et écrire les mécanismes réactionnels, il faut écrire les molécules avec la représentation de Lewis pour repérer les doublets non liants. Besoin de se rafraîchir la mémoire ? Voici qui devrait vous aider :
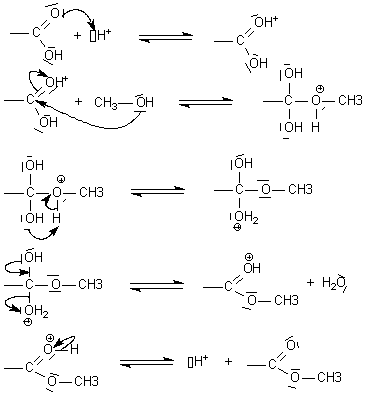
Pour une ou plusieurs étapes d’un mécanisme réactionnel donné, je sais relier par une flèche courbe les sites donneur et accepteur en vue d’expliquer la formation ou la rupture de liaisons.
Les sites donneurs sont susceptibles d’engager un doublet dans une liaison covalente. Les sites accepteurs sont susceptibles d’accepter un doublet pour faire une nouvelle liaison. Il ne reste donc plus qu’à les combiner pour faire de nouvelles liaisons dans des molécules. Lorsqu’un carbone accepteur se fait « attaquer » par un doublet d’un site donneur, il reste tétravalent. Par conséquent, il se débarrasse d’une de ses liaisons. Ce processus est instantané et les flèches doivent être faites sur le même schéma. Exemple en image sur l’estérification de l’acide éthanoïque par le méthanol en milieu acide :
CH3COOH + CH3OH = CH3COOCH3 + H2O