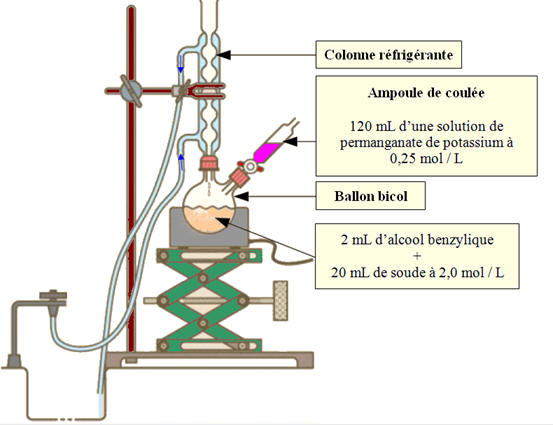
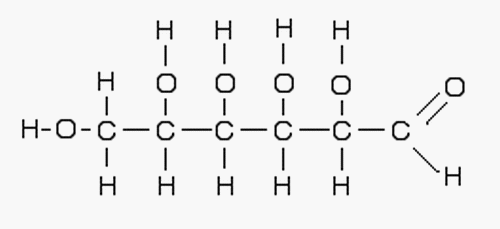
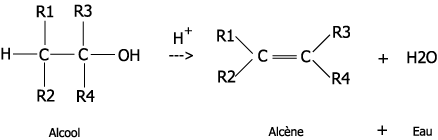
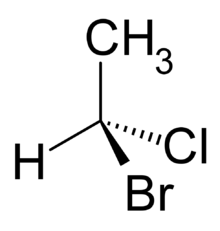
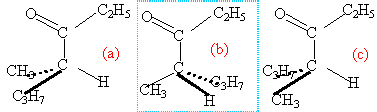
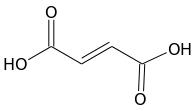
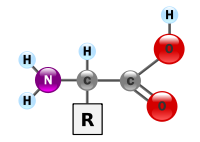
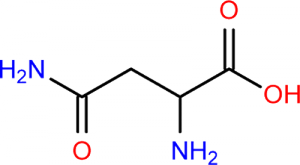
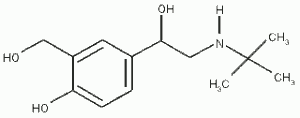
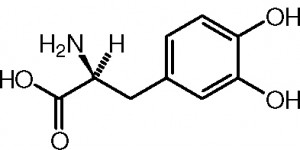
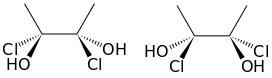Deuxième volet de cette journée : les synthèses en chimie organique. Beaucoup d’exercices sur cette thématique dans les sujets passés. Comme la chimie organique est un gros morceau du programme, il y en a toujours un petit peu. Continue reading « Bac 2019 : jour 5 – synthèse en chimie organique »