 Voilà une question qu’on entend beaucoup au début de l’année de terminale S, lorsqu’on fait le cours sur les équilibres chimiques.
Voilà une question qu’on entend beaucoup au début de l’année de terminale S, lorsqu’on fait le cours sur les équilibres chimiques.
Transformation chimique
Une transformation chimique est l’évolution d’un système chimique d’un état initial à un état final. Avant ce cours de terminale S toutes les réactions chimiques présentées sont totales. C’est à dire qu’elles ne cessent que lorsqu’il n’y a plus de réactifs. Ainsi, l’état final est défini comme l’état du système dans lequel un des réactif a complètement disparu. Dans cet état il n’y a plus de réaction car il n’y a plus de réactif pour maintenir la réaction.
En réalité, les choses ne sont pas aussi simples et comme on l’apprend en terminale, une transformation chimique traduit l’évolution du système d’un état initial hors équilibre vers un état d’équilibre dans lequel 2 réactions ont lieu dans le sens direct et indirect.
L’avancement de la réaction
Pour mesurer l’état d’avancement de la réaction, on défini une grandeur x qui est nulle initialement et qui croît tout au long de la réaction. Ainsi, dans le cas où la réaction est totale, cette grandeur atteint une valeur maximale, notée xmax. Dans le cas où la réaction n’est pas totale, celle-ci s’arrête avant que x n’atteigne cette valeur x. On note alors la valeur de l’avancement xf.
Pour résumer :
xmax correspond au cas où la réaction est totale
xf correspond au cas où la réaction n’est pas totale : xf<xmax



 Bientôt le bout du tunnel ! Mais encore faut-il réussir ses examens. Pour cela, il faut…
Bientôt le bout du tunnel ! Mais encore faut-il réussir ses examens. Pour cela, il faut… Un petit point sur la nomenclature de chimie organique. Bien sûr, vous ne pouvez pas être interrogé sur ce point pour le bac (c’est une compétence de 1s et le bac ne concerne que les compétences exigibles au programme de terminale) mais vous devez savoir nommer les esters jusqu’à 5 atomes de carbone (voir p.102 du
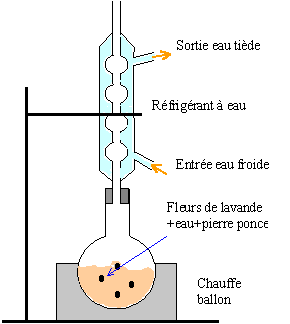
Un petit point sur la nomenclature de chimie organique. Bien sûr, vous ne pouvez pas être interrogé sur ce point pour le bac (c’est une compétence de 1s et le bac ne concerne que les compétences exigibles au programme de terminale) mais vous devez savoir nommer les esters jusqu’à 5 atomes de carbone (voir p.102 du  C’est l’époque de l’évaluation des capacités expérimentales. Vous allez bientôt être convoqué à cette évaluation. Comment bien s’y préparer ?
C’est l’époque de l’évaluation des capacités expérimentales. Vous allez bientôt être convoqué à cette évaluation. Comment bien s’y préparer ?