Et voici le corrigé du bac 2016 tombé en métropole :
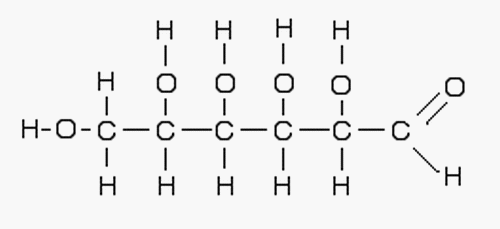
Comme une langue bien vivante

Et voici le corrigé du bac 2016 tombé en métropole :
Après la nomenclature de chimie organique et les spectres RMN, voyons ce qu’il nous reste à retenir de l’analyse spectrale pour avoir son bac version 2013 quand on est en Terminale S.
Note valables pour toutes les Fiches « capacités exigibles » : les capacités attendues sont en italique et en gras.
Je sais caractériser une espèce colorée.
Je sais exploiter des spectres UV-visible.
Une espèce chimique est colorée en solution parce qu’elle absorbe une certaine bande de longueur d’onde dans le visible :
Ainsi, la solution sera perçue avec la couleur complémentaire de celle qui a été absorbée. Pour faire le lien entre les deux couleurs (couleur absorbée, couleur perçue) on utilise un cercle chromatique :
Ainsi, pour une solution de sulfate de cuivre dont le spectre d’absorption est
Le rouge et l’orange sont absorbés. Par conséquent, la solution sera perçue bleue.
Je sais exploiter un spectre infrarouge (spectre IR) pour déterminer des groupes caractéristiques à l’aide de tables de données ou de logiciels.
Cette fois-ci, le spectre étudié n’est plus dans le visible et pour corser un peu les choses, on ne représente pas l’absorbance en fonction de la longueur d’onde mais la transmittance en fonction du nombre d’onde, généralement exprimé en cm-1. Aïe, et c’est vraiment plus compliqué ? Non pas vraiment en fait, vu ce qui est demandé.
Il s’agit de faire le lien entre, par exemple, le spectre obtenu pour l’éthanol :
et une table qui vous sera donnée, en français, bien sûr…
Donc, ici, nous trouvons une large bande à 3300 cm-1 caractéristique de la liaison O-H, un pic à 3000 cm-1 qui correspond aux liaisons C-H et enfin deux pics autour de 1100 qui correspondent à la liaison C-O cm-1. Tout cela est cohérent avec la formule de l’éthanol : CH3-CH2-OH.
Avec un spectre IR on détermine les fonctions caractéristiques mais on ne sait pas où elles sont. Pour cela, on doit procéder à une étude RMN.
En TS, vous voilà perdu avec les spectres RMN ? Pas de panique, voyons un peu ce qu’il faudra en retenir :
Je sais relier un spectre RMN simple à une molécule organique donnée, à l’aide de tables de données ou de logiciels.
Je sais identifier les protons équivalents et relier la multiplicité du signal au nombre de voisins.
Grande nouveauté du Bac 2013, la spectroscopie RMN sera donc surtout utilisée dans les sujets pour déterminer si un échantillon contient une molécule de formule donnée. Voyons un peu de quoi il s’agit.

RMN signifie Resonance Magnétique Nucléaire. Le principe consiste à soumettre un échantillon à un très fort champ magnétique ce qui permet d’aligner le spin des noyaux d’atome d’hydrogène. Ce champ est produit par des supraconducteurs. Cette technique est donc coûteuse et « massive ».
En « titillant » ces noyaux à l’aide d’un champ magnétique perpendiculaire au premier et ayant la bonne fréquence, ceux-ci vont réagir en produisant un signal qui sera analysé par un ordinateur :

C’est un peu comme si en tapant sur les noyaux d’hydrogène et en analysant leur réponse, ceux-ci nous donnait des informations sur leur environnement. La méthode fait penser aux cheminots de l’ancien temps qui frappaient les roues des wagon pour vérifier que tout allait bien. Pour comprendre comment fonctionne la RMN, on peut voir cette animation java, expliquée ici (en anglais avec un accent danois).
Cette méthode n’est pas qu’utilisée en chimie, elle permet d’obtenir de beaux clichés de l’intérieur du corps sans avoir à l’ouvrir (ce qui est assez pratique vous en conviendrez). En médecine, on n’appelle pas ça la RMN mais IRM. On a remplacé le N de nucléaire par le I de imagerie. C’est exactement la même chose mais ça fait un peu moins peur aux patients…
Pour le bac, il faut être capable d’interpréter un spectre RMN. Il n’est pas demandé de comprendre le principe, je ne m’étendrais donc pas sur ce sujet. Un spectre RMN en chimie ressemble à ça :
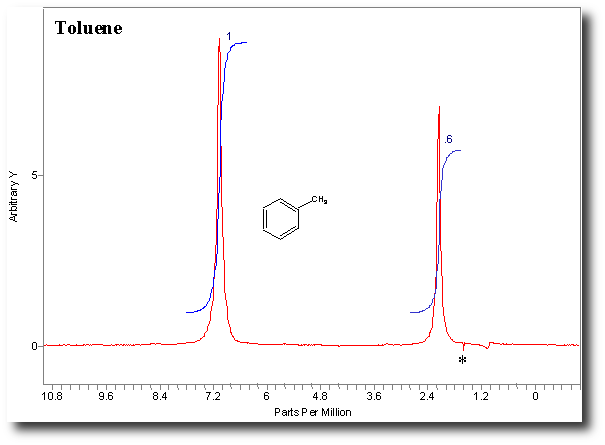
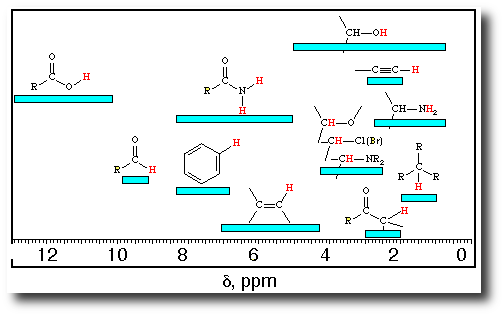
En abscisse, c’est le déplacement chimique. On n’a pas besoin, en terminale, de savoir à quoi ça correspond. Il faut juste retenir que le zéro est à droite (oui, je sais encore une bizarrerie, comme pour les spectres IR) et que s’il y a un pic en zéro on ne s’en occupe pas. Ce qu’il va falloir analyser ce sont les autres pics. Ceux-ci correspondent à certains noyaux d’atomes d’hydrogène de la molécule. Leur position dans le spectre nous renseigne sur le groupe d’atomes, donc la fonction :
Comme un noyau d’hydrogène est simplement un proton, on parle plutôt de protons en RMN que d’hydrogène. Sur le spectre du toluène ci-dessus, on remarque 2 pics alors que la molécule présente 8 protons (3 sur le groupe méthyl et 5 sur le cycle aromatique). Ceci vient du fait que des protons équivalents résonnent de la même façon. Voici une première règle qu’il va falloir retenir :
Dans un spectre RMN, les protons équivalents, c’est à dire ceux qui ont le même environnement chimique, ont la même valeur de déplacement chimique
Ainsi, les protons sont tous cachés dans les pics et il ne suffit pas d’identifier un pic pour savoir à combien de protons il correspond. Pour résoudre cette énigme, les chimistes utilisent la courbe d’intégration. Kézako que ce truc ? Il s’agit d’une courbe qui en x prend comme valeur la somme de toutes les valeurs du spectre précédant x. Dans notre cas où le spectre est une suite de pics, la courbe d’intégration est nulle avant le premier pic puis garde la valeur du premier pic jusqu’au second, etc. Elle forme donc un palier comme on peut le voir ci-dessous :
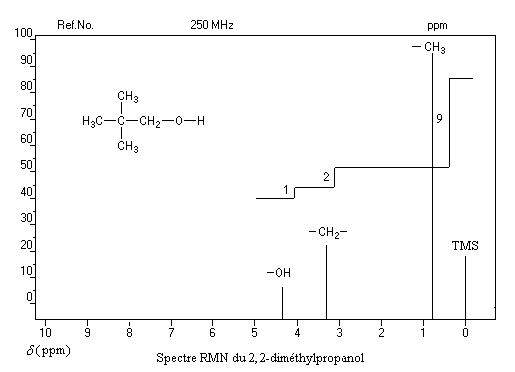
La « hauteur de marche » correspond donc au nombre de protons qui se cachent dans le pic. Ici, il y a 1 proton dans la fonction alcool, 2 dans CH2 et 9 dans des groupements méthyl CH3. On pourra s’amuser avec les spectres présentés dans le paragraphe Signal strength de cette page. En cliquant sur les pics, on voit apparaître les courbes d’intégration correspondantes.
Si les choses pouvaient s’arrêter là, ce serait bien mais il y a encore une petite chose qu’il faut connaître à propos des spectres RMN : la notion de multiplicité du signal. Sur le spectre de l’éthanol ci-dessous,
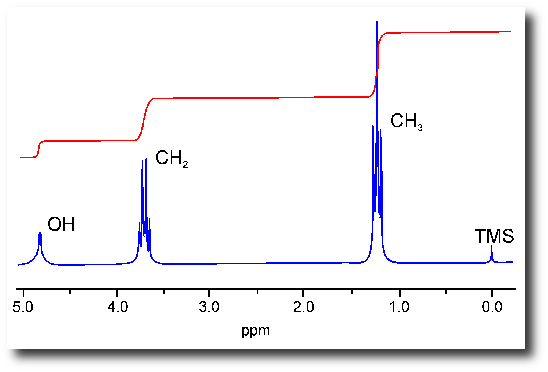
on observe que les pics sont constitués en fait de plusieurs pics : un singulet (un seul pic) puis un quadruplet (4 pics) et enfin un triplet (3 pics). Cela vient de l’influence des différents protons les uns sur les autres. Prenons le quadruplet du milieu. Il est due aux deux protons rattachés au carbone du milieu (HO-CH2-CH3). Pourquoi n’observe-t-on pas simplement un grand pics ? Tout simplement parce que les protons portés par les carbones voisins ont une influence sur ces deux protons. Ainsi, les 3 protons qui sont portés par le carbone du groupement méthyl (HO-CH2-CH3) vont éclater ce pic en 4 pics. Pour ces protons qui « voient » les 2 protons du milieu, le pic est éclaté en 3 pics. C’est la règle des (n+1)-uplet :
un proton ou un groupe de protons équivalents ayant n protons voisins équivalents donne un signal constitué de (n+1) pics.
Quand on dit voisins, on veut dire portés par un carbone voisin de celui qui porte le proton considéré. Ok, mais alors pourquoi le proton porté par l’oxygène de la fonction alcool (HO-CH2-CH3) n’est pas un 2+1-uplet, c’est à dire un triplet ? Il a bien 2 protons voisins, non ? Oui, ils semblent avoir deux voisins… mais non car
les protons des groupes OH, COOH et NH ne peuvent se coupler avec les autres.
C’est bizarre ce truc. Oui mais c’est comme ça. Et il va falloir le retenir.
Ouf ! Nous avonc vu tout ce qu’il faut retenir pour traiter les spectres RMN pour le bac 2013. Il va falloir maintenant mettre tout ça en pratique avec des exercices. Il ne vous sera pas demandé de trouver la formule d’une molécule inconnue à partir d’un spectre RMN, c’est bien trop compliqué mais de relier une molécule à son spectre RMN. Comment faire ? Voici la méthode :
Bon courage !
Un petit point sur la nomenclature de chimie organique. En fouillant un peu dans mon blog, j’ai retrouvé un vieil article sur la nomenclature (de 2007, on est vite vieux sur internet !), il n’est plus tout à fait à jour pour le bac version 2013 et je vais tenter de le dépoussiérer un peu. Pour ce dernier, deux compétences exigibles du programme correspondent à ce thème :
Je sais associer un groupe caractéristique à une fonction dans le cas des alcools, aldéhyde, cétone, acide carboxylique, ester, amine, amide.
Je connais les règles de nomenclature de ces composés ainsi que celles des alcanes et des alcènes.
Il y a donc beaucoup de choses à savoir et un petit récapitulatif ne peut pas faire de mal. Les règles importantes sont mises en exergue. Les ramifications sont notées de la manière suivante :
| CH3-CH-CH2-CH3 . | . CH3 |
CH3-CH(CH3)-CH2-CH3 |
Pour donner un nom à un alcane, on commence par compter le nombre de carbone de la chaîne carbonnée qui a le plus de carbone (si l’alcane est ramifié) et on lui donne comme nom en fonction du nombre de carbone :
methane (pour 1 carbone), éthane (2), propane (3), butane (4), pentane (5), hexane (6), heptane (7), octane (8), nonane (9), decane (10).
A priori, pour le bac, on devrait pouvoir s’arrêter à 8 atomes de carbone.
Dans le cas où l’alcane est ramifié, on rajoute avant le nom de la molécule : méthyl, éthyl, propyl, etc… selon le nombre d’atomes de carbone de la branche, précédé du numéro de l’atome de carbone qui porte la ramification.
Il faut commencer à numéroter de sorte à obtenir les plus petits nombres possibles
par exemple : CH3-CH(CH3)-CH2-CH2-CH3. Il y a 5 atomes de carbones sur la chaîne la plus longue c’est donc un pentane. Il y a une ramification avec un atome de carbone (méthyl) porté par le carbone n° 2 (on part de gauche pour avoir le plus petit nombre possible). Le nom de la molécule est donc 2-méthylpentane
Autre exemple : CH3-CH(CH3)-CH2-CH(C2H5)-CH2-CH3. Il y a 6 atomes sur la chaîne la plus longue : c’est un hexane. Il y a 2 ramifications, l’une avec 1 atome de carbone (méthyl) et l’autre avec 2 atomes (éthyl). Le nom complet est donc : 4-éthyl-2-méthylhexane
Lorsqu’il y a plusieurs ramifications, on les classe par ordre alphabétique.
Lorsqu’il n’y a pas d’ambiguité sur la position de la ramification, on ne précise pas sa position. Exemple : dans le cas du méthylpropane, le groupement méthyl est forcément sur le carbone du milieu.
Exercice : les molécules suivantes sont mal nommées, corriger le nom : 2-méthylbutane, 3 propylpropane, éthylpropane
Un groupe caractéristique est un ensemble d’atomes composé :
Voici les différentes familles de molécules que l’on rencontre au lycée (où R, R’ et R » représentent des groupement alkyle, c’est à dire ne contenant que des atomes de carbone et d’hydrogène) :
| Groupe caractéristique |
Famille | Nomenclature : suffixe ou préfixe | Exemple |
| C=C | Alcène | -ène | Propène |
| R-OH | Alcool | -ol | 2-méthylpentan-1-ol |
| R-CH=O | Aldéhydes | -al | 3-méthylbutanal |
| R-CO-R’ | Cétone | -one | 2-éthylpentan-3-one |
| R-COOH | Acide carboxylique | acide …-oïque | Acide butanoïque |
| R-COO-R’ | Ester | …-oate de …-yle | Pentanoate d’éthyle |
| R-N(R »)-R’ | Amine | -amine | propan-2-amine, N-éthyl-butan-1-amine, N-méthyl-N-éthyl-propan-2-amine |
| R-CO-N(R »)-R’ | Amide | -amide | N-éthyl-3-méthylpentanamide |
Les règles de nomenclature de ces familles sont issues de celles des alcanes pour le nom des molécules et pour les ramifications. On rajoute les règles suivantes :
La chaîne carbonée principale doit contenir la fonction principale qui donne le nom à la molécule
On indique la position de la fonction avant le suffixe de la fonction
Ex : CH3-CH2-CH=CH-CH3 est le pentan-2-ène.
La fonction principale doit avoir le plus petit numéro possible
Ainsi, pour les aldéhydes et les acides carboxyliques, l’atome portant la fonction a toujours le numéro 1.
Exemple : CH3-CH2-CH(COOH)-CH2-CH2-CH3 est l’acide 2-éthyl-pentanoïque alors que la chaîne la plus longue contient 6 atomes de carbone mais ne contient pas la fonction principale.
Pour les amines et les amides, les groupements alkyles portés par l’azote sont ajoutés avant la chaîne principale précédé de N.
Exemple pour les amines : CH3-CH2-CH(CH3)-N(CH3)-C2H5 se nomme la N-éthyl-N-méthyl-1-méthylpropanamine.
Exemple pour les amides : CH3-CH2-CH2-CO-NH-CH3 se nomme la N-méthylbutanamide.
A titre d’exercice, on pourra s’entraîner à écrire la formule semi-développée des exemples du tableau.
buy windows 11 pro test ediyorum