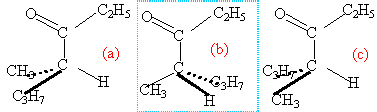
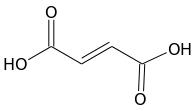
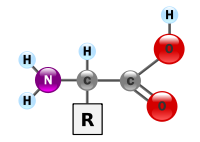
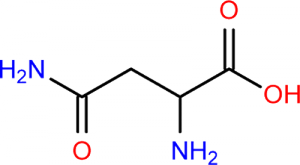
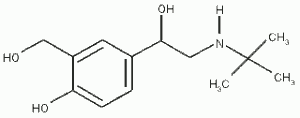
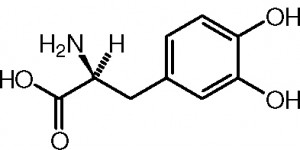
Voilà une nouvelle partie du programme de sciences physique et chimie de terminale S. Nous sommes à l’interface avec la spécialité informatique et sciences du numériques. Voyons un peu ce qu’il faut retenir de cette partie. Continue reading « Transmettre de l’information : que faut-il retenir pour le bac 2013 ? »