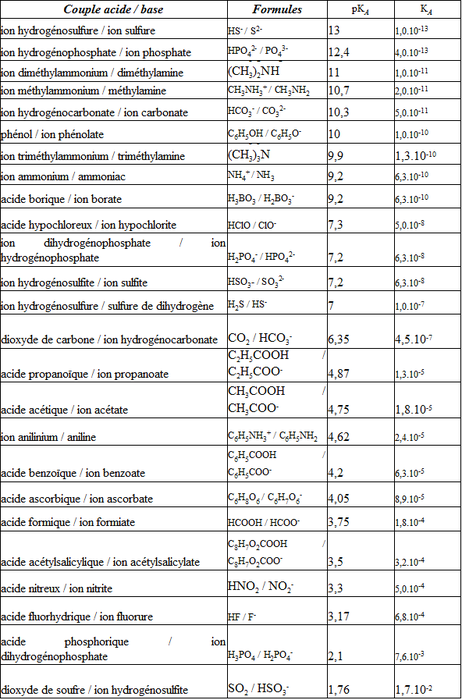
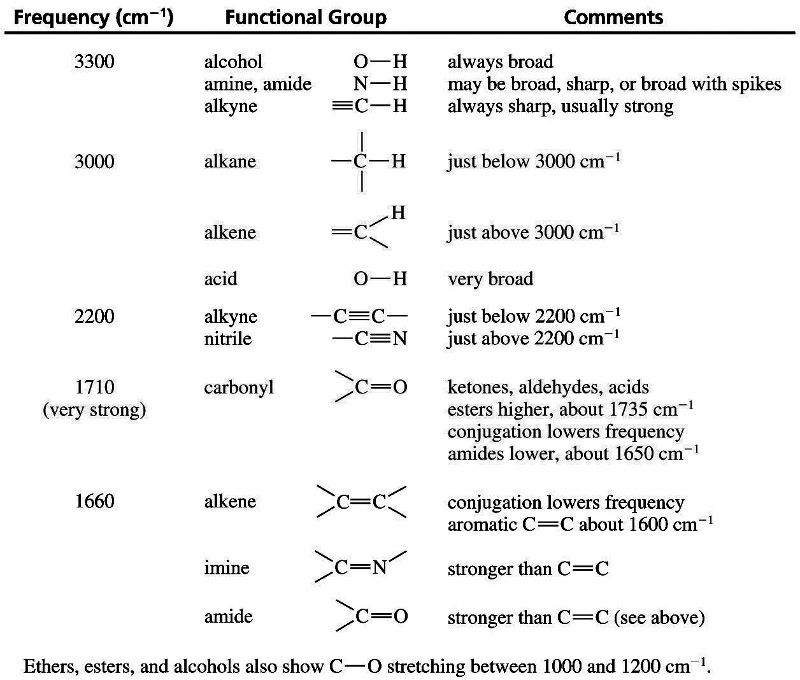
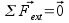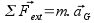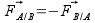La partie sur le temps du programme de bac 2013 se termine par la cinétique chimique. Dans cette partie il faut comprendre que toutes les réactions chimiques ne sont pas instantanées. Certaines mettent un certain temps à atteindre l’état final et il y a quelques compétences autour de cette notion que l’on doit maîtriser avant d’aborder l’épreuve du bac. Voyons un peu quelles sont les 5 compétences exigibles de cette partie.
Je sais comment suivre dans le temps une synthèse organique par CCM et en estimer la durée.
Envisageons la réaction entre l’éthanol et l’acide éthanoïque, donnant de l’éthanoate d’éthyle et de l’eau : CH3CH2OH (l) + CH3COOH (l) ? CH3COOCH2CH3 (l) + H2O (l)
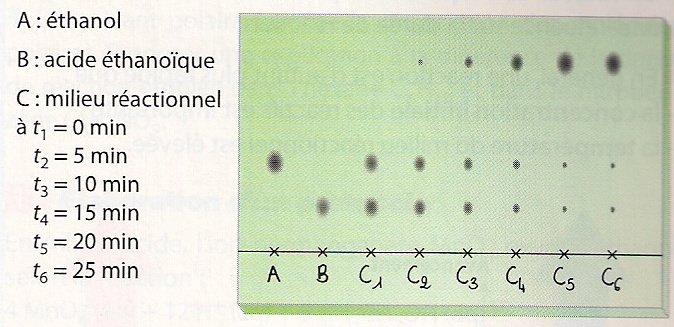
Cette réaction est assez lente, et on peut en suivre la cinétique à l’aide d’une chromatographie sur couche mince (CCM – besoin d’un rappel ? Voir cette animation sur la CCM). On obtient :
Sur cette chromatographie, on identifie les 2 réactifs à l’aide des témoins A & B. L’instant initial correspond à la tâche C1 pour laquelle on voit qu’il n’y a que les réactifs. Dès 5 minutes, en C2, une nouvelle tâche apparaît : c’est l’éthanoate d’éthyle. Progressivement, les tâches correspondant à l’ester, l’éthanoate d’éthyle, apparaissent tandis que les tâches correspondant aux réactifs s’estompent. Dans ce cas, on peut estimer la durée de réaction à environ 30 minutes. Bien entendu cette méthode n’est pas très précise.
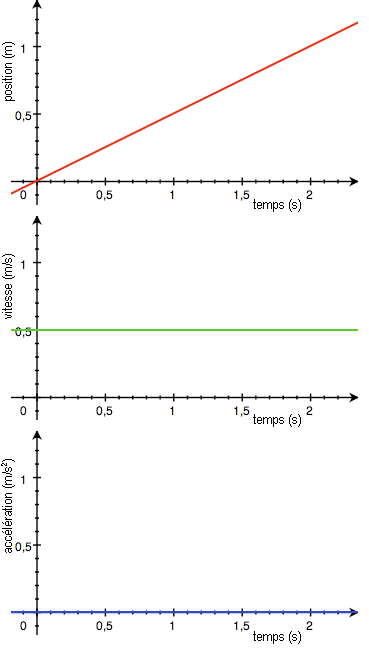
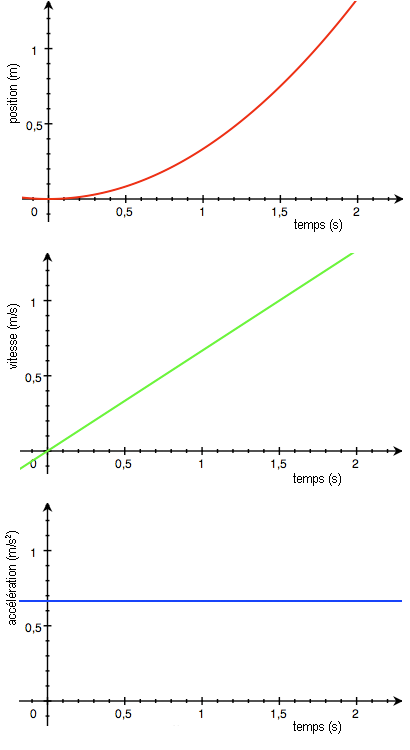
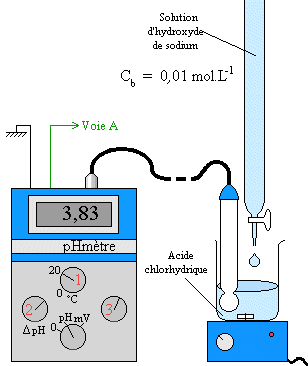
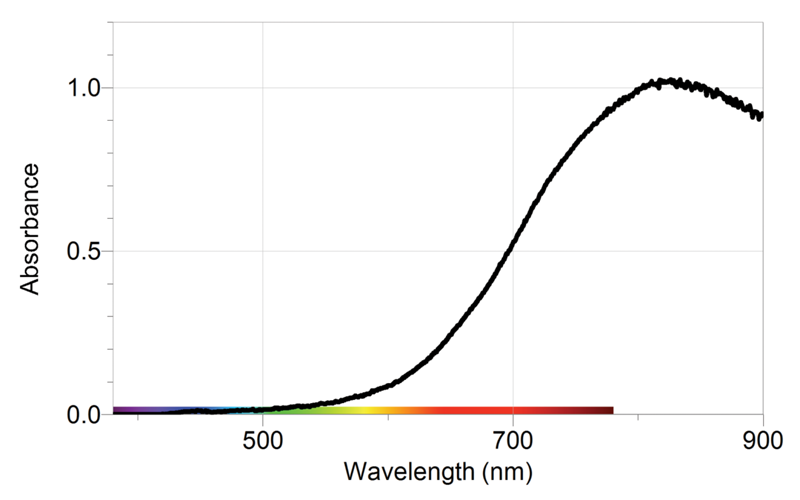
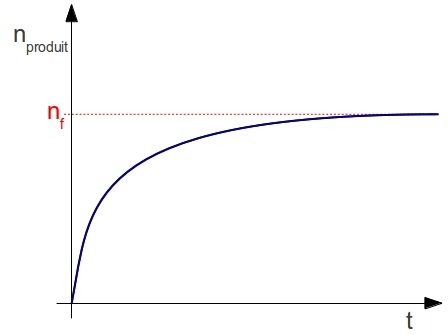
Pour plus de précision, on utilisera des méthodes permettant de déterminer la quantité de réactifs disparus ou de produits obtenus comme les titrages (voir la partie correspondante du programme). On supposera par la suite qu’on utilise de tels méthodes qui nous permettent de tracer la quantité de produit obtenu au cours du temps :
Je sais mettre en évidence quelques paramètres influençant l’évolution temporelle d’une réaction chimique : concentration, température, solvant.
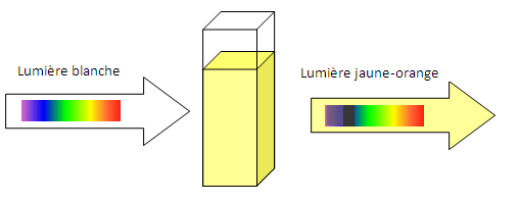
La concentration des réactifs, la température ou la nature du solvant sont des facteurs cinétiques c’est à dire qu’ils améliorent la cinétique d’une réaction. Pour le mettre en évidence, on modifie l’un de ces facteurs et on compare la courbe obtenue à celle sans modification du facteur :
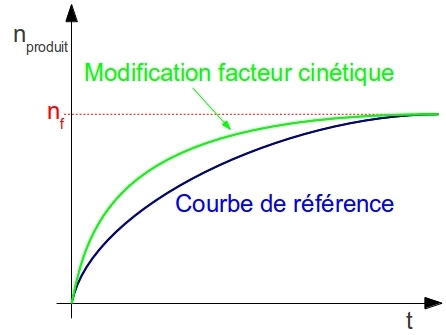
Au final on retiendra que la température augmente la cinétique car plus elle est élevée et plus on obtient rapidement de produit. De la même façon, la concentration des réactifs augmente la cinétique.
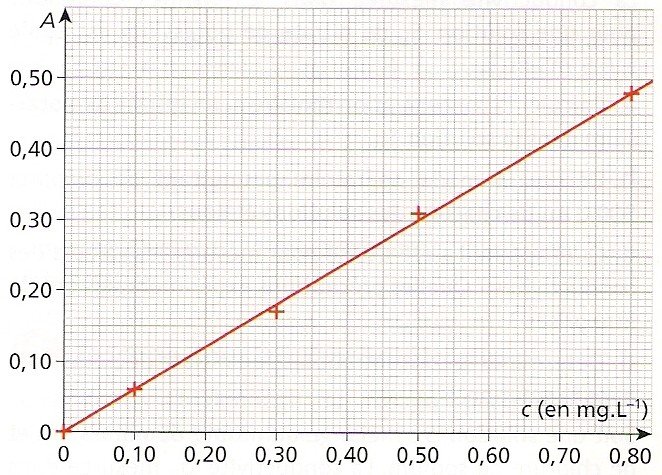
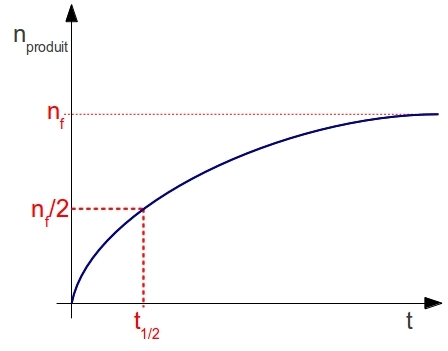
Je sais déterminer un temps de demi-réaction.
Le temps de demi-réaction est le temps qu’il faut pour que le système chimique soit à la moitié du chemin qu’il doit parcourir. Autrement dit, en utilisant la notion d’avancement chimique : x(t1/2)=xf/2. Sur un graphique tel que celui utilisé jusqu’ici, le temps de demi-réaction se détermine de la façon suivante :
Je sais mettre en évidence le rôle d’un catalyseur. Je sais extraire et exploiter des informations sur la catalyse, notamment en milieu biologique et dans le domaine industriel, pour en dégager l’intérêt.
Mettre en évidence le rôle d’un catalyseur est analogue à mettre en évidence le rôle d’un facteur cinétique, rien de bien compliqué ici.
La catalyse est extrêmement importante en chimie et est un domaine de recherche majeur. En effet, elle permet un contrôle précis des processus réactionnel. Dans les organismes vivants, tout est une histoire de catalyse : tel enzyme présente ici permet une réaction qui est impossible là-bas où elle n’est pas présente. Le CNRS propose un site dédié à la catalyse : une lecture de ce site en prenant des notes est un bon entraînement à cette compétence exigible (en particulier la partie « les grandes notions expliquées »).


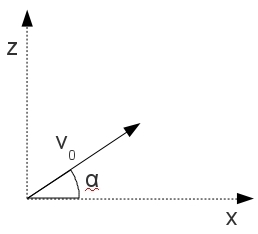
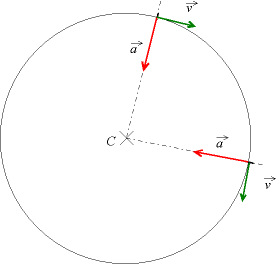
 Pour bien définir le vecteur accélération, il faut avoir une idée claire sur ce qu’on appelle la vitesse. Dans la vie de tous les jours, la vitesse est un scalaire (un chiffre), alors qu’en physique c’est un vecteur, défini par sa norme, sa direction et son sens. Sa norme correspond à la définition de la vie de tous les jours : la distance parcourue par unité de temps (la seconde en physique), sa direction est tangente à la trajectoire et son sens est celui du mouvement.
Pour bien définir le vecteur accélération, il faut avoir une idée claire sur ce qu’on appelle la vitesse. Dans la vie de tous les jours, la vitesse est un scalaire (un chiffre), alors qu’en physique c’est un vecteur, défini par sa norme, sa direction et son sens. Sa norme correspond à la définition de la vie de tous les jours : la distance parcourue par unité de temps (la seconde en physique), sa direction est tangente à la trajectoire et son sens est celui du mouvement.